Entity
Kimya 06: Güçlü Etkileşimler
Atomların nasıl bir araya gelerek molekülleri oluşturduğunu biliyor musunuz? Bu içerikte, atomların bağlanma yollarını, iyonik ve kovalent bağlar ile bağ kutuplaşması da dahil olmak üzere inceleyeceğiz.
Etkinlik:
I. İyonik Bağlar:
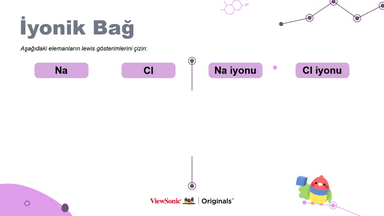
● Na ve Cl'nin Lewis sembollerini çizerek NaCl'deki iyonik bağı açıklayın.
● Öğrenciler, her molekülde nasıl iyonik bağ oluşturduklarını anlamak için elementlerin Lewis sembollerini çizebilirler.
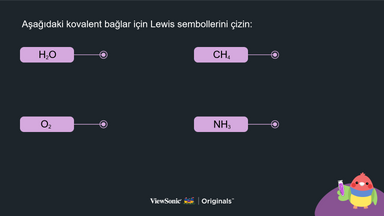
II. Kovalent Bağlar:
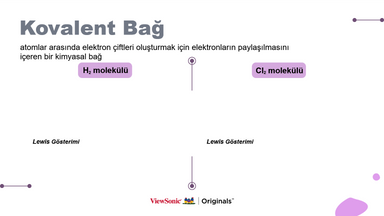
● Her molekülün Lewis yapısını çizerek kovalent bağ kavramını açıklayın.
● Tekli, çiftli ve üçlü bağların nasıl işlediğini, her molekülün Lewis yapısını çizerek anlatın.
● Öğrenciler, her molekülde nasıl kovalent bağ oluşturduklarını anlamak için elementlerin Lewis sembollerini çizebilirler.
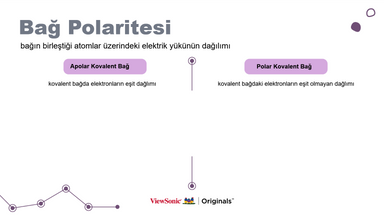
III. Bağ Polarlığı:
● Bağ kutuplaşması kavramını açıklayın ve apolar kovalent bağlar ile polar kovalent bağlar arasındaki farkı çizimlerle gösterin.
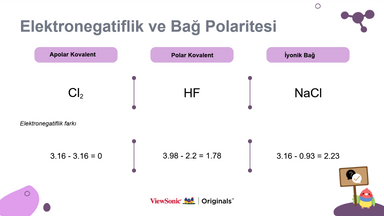
● Elektronegativite ile apolar kovalent, polar kovalent ve iyonik bağ arasındaki ilişkiyi gösterin.
● 💡 Originals İpucu: “Anket” özelliğini kullanarak öğrencilerin problemlere verdiği yanıtları girmelerini sağlayın. Ardından, sınıf sonuçlarını görüntüleyin ve tartışın.
Milli Eğitim Bakanlığı Müfredat Kazanımı
Kimya 9. Sınıf :
9.3.2.1. Kimyasal türler arasındaki etkileşimleri sınıflandırır.
a. Bağlanan türler arası sınıflandırma, atomlar arası ve moleküller arası şeklinde yapılır; bu sınıflandırmanın getirdiği güçlüklere değinilir.
b. Güçlü etkileşimlere örnek olarak iyonik, kovalent ve metalik bağ; zayıf etkileşimlere örnek olarak da hidrojen bağı ve van der Waals kuvvetleri verilir.
9.3.3.1. İyonik bağın oluşumunu iyonlar arası etkileşimler ile ilişkilendirir.
a. Nötr atomların ve tek atomlu iyonların Lewis sembolleri verilir. Örnekler periyodik sistemdeki ilk 20 element arasından seçilir.
b. İyonik bileşiklerin yapısal birimleri ile molekül kavramının karıştırılmamasına vurgu yapılır.
c. İyonik bağların açıklanmasında bilişim teknolojilerinden (animasyon, simülasyon, video vb.) yararlanılır.
9.3.3.2. İyonik bağlı bileşiklerin sistematik adlandırmasını yapar.
a. Tek atomlu ve çok atomlu iyonların (NH4 + , OH- , NO3 - , SO4 2- , CO3 2- , PO4 3- , CN- , CH3COO- ) oluşturduğu bileşiklerin adlandırılması yapılır.
b. Değişken değerlikli metallerin (Cu, Fe, Hg, Sn, Pb) oluşturduğu bileşiklerin adlandırılması yapılır.
c. Hidrat bileşiklerinin adlandırılmasına girilmez.
9.3.3.3. Kovalent bağın oluşumunu atomlar arası elektron ortaklaşması temelinde açıklar.
a. Kovalent bağlar sınıflandırılırken polar ve apolar kovalent bağlar verilir; koordine kovalent bağa girilmez.
b. Basit moleküllerin (H2, Cl2, O2, N2, HCl, H2O, BH3, NH3, CH4, CO2) Lewis elektron nokta formülleri üzerinden bağın ve moleküllerin polarlık-apolarlık durumları üzerinde durulur.
c. Kovalent bağların açıklanmasında bilişim teknolojilerinden (animasyon, simülasyon, video vb.) yararlanılır.
9.3.3.4. Kovalent bağlı bileşiklerin sistematik adlandırmasını yapar. H2O, HCl, H2SO4, HNO3, NH3 bileşik örneklerinin sistematik adları verilir.