Entity
Kimya 07: Zayıf Etkileşimler
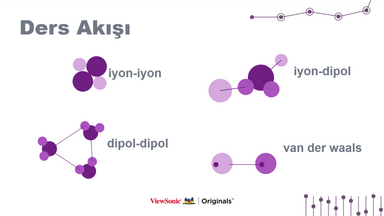
Moleküllerin nasıl birlikte durabildiklerini biliyor musunuz? Bu içerikte, moleküller arasında mevcut olan farklı bağ türlerinden, iyon-iyon, iyon-dipol, dipol-dipol ve Van der Waals bağları dahil olmak üzere bahsedeceğiz.
Etkinlik:
I. Molekül içi Kuvvetler ve Moleküller Arası Kuvvetler:
● Molekül içi kuvvetler (Güçlü etkileşimler) ile moleküller arası kuvvetler (Zayıf etkileşimler) arasındaki farkları örnekler çizerek açıklayın.
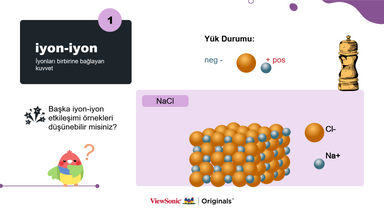
II. İyon-iyon:
● İyon-iyon etkileşimine bir örnek vererek kavramı açıklayın.
● Formal yükün ne olduğunu gösterin ve açıklayın.
● 💡 Originals İpucu: “Anlık Quiz” özelliğini kullanarak öğrencilerin probleme verdikleri yanıtları “fırlatmalarını” isteyin.
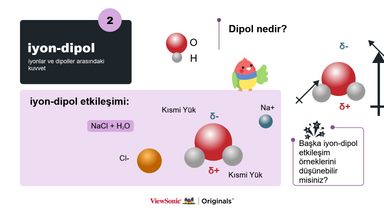
III. İyon-dipol:
● İyon-dipol etkileşimine bir örnek vererek kavramı açıklayın.
● Dipolün ne olduğunu ve kısmi negatif ile kısmi pozitif yükün bununla nasıl ilişkili olduğunu açıklayın.
● 💡 Originals İpucu: “Anlık Quiz” özelliğini kullanarak öğrencilerin probleme verdikleri yanıtları “fırlatmalarını” isteyin.
● PhET Etkinliği: Öğretmenler/öğrenciler, molekül kutuplaşmasını daha iyi anlamak ve görselleştirmek için PhET'ten yararlanabilirler.
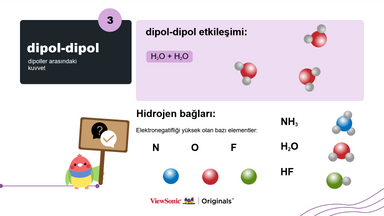
IV. Dipol-dipol:
● Dipol-dipol etkileşimine bir örnek vererek kavramı açıklayın.
● Hidrojen bağlarının ne olduğunu gösterin ve açıklayın.
● 💡 Originals İpucu: “Anket” özelliğini kullanarak öğrencilerin problemlere verdikleri yanıtları girmelerini isteyin. Sonra, sınıf sonuçlarını görüntüleyin ve tartışın.
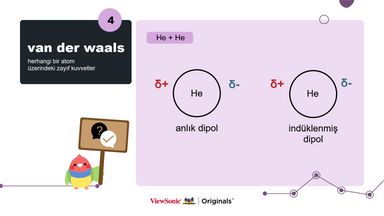
V. Van der Waals:
● Van der Waals etkileşimine bir örnek vererek geçici dipol, indüklenmiş dipol ve Van der Waals kavramını açıklayın.
● 💡 Originals İpucu: “Anket” özelliğini kullanarak öğrencilerin problemlere verdikleri yanıtları girmelerini isteyin. Sonra, sınıf sonuçlarını görüntüleyin ve tartışın.
Milli Eğitim Bakanlığı Müfredat Kazanımı
Kimya 9. Sınıf
9.3.4.1. Zayıf ve güçlü etkileşimleri bağ enerjisi esasına göre ayırt eder.
9.3.4.2. Kimyasal türler arasındaki zayıf etkileşimleri sınıflandırır.
a. Van der Waals kuvvetleri (dipol-dipol etkileşimleri, iyon-dipol etkileşimleri, dipol-indüklenmiş dipol etkileşimleri, iyon-indüklenmiş dipol etkileşimleri ve London kuvvetleri) açıklanır.
b. Dipol-dipol etkileşimleri, iyon-dipol etkileşimleri ve London kuvvetlerinin genel etkileşme güçleri karşılaştırılır.
9.3.4.3. Hidrojen bağları ile maddelerin fiziksel özellikleri arasında ilişki kurar.
a. Hidrojen bağının oluşumu açıklanır.
b. Uygun bileşik serilerinin kaynama noktası değişimleri grafik üzerinde, hidrojen bağları ve diğer etkileşimler kullanılarak açıklanır.
c. Aziz Sancar’ın DNA’nın onarımı ile ilgili çalışmalarına ve kısa biyografisine okuma parçası olarak yer verilir. Sabırlı, azimli ve kararlı olmanın bilimsel çalışmalarda başarıya ulaşmadaki önemi vurgulanır.