Entity
Kimya 05:Kimyasal Formül
Atom ve moleküllerin gösterim yollarının ne kadar çeşitli olduğunu biliyor musunuz? Bu içerikteki etkinlikte, öğrenciler molekülleri göstermenin farklı yollarını inceleyecek ve moleküler ile ampirik formüller yazma pratiği yapacaklar.
Etkinlikler:
I. Kimyasal Formül
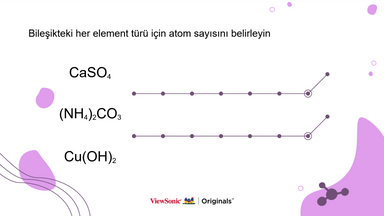
● Kimyasal formülün ne olduğunu tanıtın ve her molekül için atom sayısını yazarak alt simgenin ne anlama geldiğini açıklayın.
● Öğrenciler, her bir örnek molekülün atom sayısını yazarak anladıklarını test edebilir ve pratik yapabilirler.
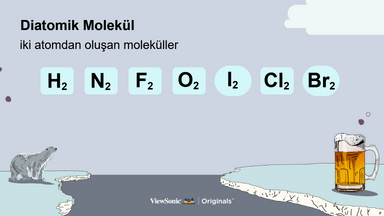
II. İki Atomlu Moleküller
● Yedi iki atomlu molekülü, maddenin hallerini ve bu molekülleri ezberlemek için kullanılan mnemonik aygıtı açıklayın.
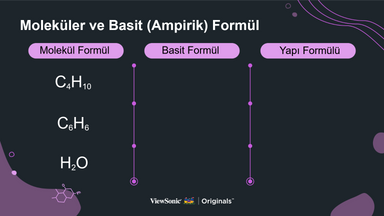
III. Moleküler ve Ampirik Formül
● Moleküler, ampirik ve yapısal formülleri, her bir örnek molekülün formüllerini yazarak ve çizerek açıklayın.
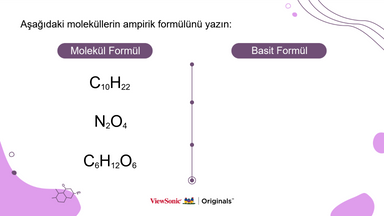
● Öğrenciler, her bir örnek molekülün ampirik formülünü yazarak anladıklarını test edebilir ve pratik yapabilirler.
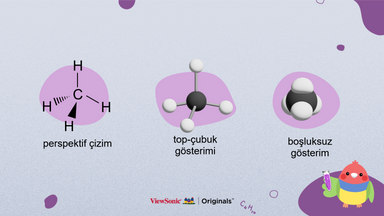
IV. Molekülleri Görselleştirme
● Molekülleri sunmanın diğer yollarını gösterin.
V. Sürükle ve Bırak
Öğrenciler, molekülleri doğru kutuya sürükleyerek anladıklarını test edebilirler.
Milli Eğitim Bakanlığı Müfredat Kazanımı
Kimya 9. Sınıf
9.1.3.2.Bileşiklerin formüllerini adlarıyla eşleştirir.
a. Bileşik tanımı yapılır.
b. H2O, HCl, H2SO4, HNO3, CH3COOH, CaCO3, NaHCO3 , NH3, Ca(OH)2, NaOH, KOH, CaO ve NaCl bileşiklerinin yaygın adları tanıtılır.
9.3.3.1. İyonik bağın oluşumunu iyonlar arası etkileşimler ile ilişkilendirir.
a. Nötr atomların ve tek atomlu iyonların Lewis sembolleri verilir. Örnekler periyodik sistemdeki ilk 20 element arasından seçilir.
b. İyonik bileşiklerin yapısal birimleri ile molekül kavramının karıştırılmamasına vurgu yapılır.
c. İyonik bağların açıklanmasında bilişim teknolojilerinden (animasyon, simülasyon, video vb.) yararlanılır.
9.3.3.2. İyonik bağlı bileşiklerin sistematik adlandırmasını yapar.
a. Tek atomlu ve çok atomlu iyonların (NH4 + , OH- , NO3 - , SO4 2- , CO3 2- , PO4 3- , CN- , CH3COO- ) oluşturduğu bileşiklerin adlandırılması yapılır.
b. Değişken değerlikli metallerin (Cu, Fe, Hg, Sn, Pb) oluşturduğu bileşiklerin adlandırılması yapılır.
c. Hidrat bileşiklerinin adlandırılmasına girilmez.
9.3.3.3. Kovalent bağın oluşumunu atomlar arası elektron ortaklaşması temelinde açıklar.
a. Kovalent bağlar sınıflandırılırken polar ve apolar kovalent bağlar verilir; koordine kovalent bağa girilmez.
b. Basit moleküllerin (H2, Cl2, O2, N2, HCl, H2O, BH3, NH3, CH4, CO2) Lewis elektron nokta formülleri üzerinden bağın ve moleküllerin polarlık-apolarlık durumları üzerinde durulur.
c. Kovalent bağların açıklanmasında bilişim teknolojilerinden (animasyon, simülasyon, video vb.) yararlanılır.
9.3.3.4. Kovalent bağlı bileşiklerin sistematik adlandırmasını yapar. H2O, HCl, H2SO4, HNO3, NH3 bileşik örneklerinin sistematik adları verilir.